Son Güncelleme:29.05.2025
Genler, canlıların temel kalıtım birimleri olup, işlevlerini doğru şekilde yerine getiremediklerinde birçok hastalığın ortaya çıkmasında önemli rol oynarlar. Genetik kodlarımızdaki küçük bir hata bile ömür boyu sürecek sağlık sorunlarına yol açabilir, hatta bu hatalar çocuklarımıza geçerek onların da aynı hastalıktan muzdarip olmasına neden olabilir.
çıkmasında önemli rol oynarlar. Genetik kodlarımızdaki küçük bir hata bile ömür boyu sürecek sağlık sorunlarına yol açabilir, hatta bu hatalar çocuklarımıza geçerek onların da aynı hastalıktan muzdarip olmasına neden olabilir.
Yaşam tarzımıza dikkat ederek bazı genetik hastalıkların (örneğin tip 2 diyabet veya bazı kanser türleri) ortaya çıkmasını önleyebiliriz. Bazı genetik hastalıkları ise ilaç tedavisiyle kontrol altında tutmak mümkündür.
Genetik hastalıklar kimi zaman yaşlılıkta, kimi zaman gençlikte, çocuklukta veya anne karnında, döllenmeden hemen sonra kendini gösterebilir. Genetik hastalıkların çoğu geç çocukluk dönemi ile yetişkinlik döneminde ortaya çıkar. Genel kabul gören görüşe göre, genetik rahatsızlıkların %75’inin belirtileri ileri yaşlarda görülür.
Aşağıdaki yazıda ele alınan ve doğumla birlikte ortaya çıkan genetik hastalıkların toplumda görülme sıklığı sadece %4’tür.
Bu yazıda, kromozomlar düzeyinde meydana gelen ve henüz tedavisi mümkün olmayan üç ağır genetik hastalık ele alınacaktır: Trizomi 21 (Down Sendromu), Trizomi 18 (Edwards Sendromu) ve Trizomi 13 (Patau Sendromu). Bu üç hastalık da kromozomal kökenli olup, yumurta döllendikten sonraki hücre bölünmeleri sırasında meydana gelen bir hatadan kaynaklanır. Hata ne kadar geç bölünmede gerçekleşirse, hastalığın semptomları da o kadar hafif olma eğilimindedir.
Ayrıca, hatanın hangi kromozomda olduğu, kromozomun tamamında mı yoksa bir parçasında mı olduğuna bağlı olarak semptomlarda farklılıklar görülür. Konuyu daha anlaşılır ve mümkün olduğunca basite indirgeyerek, biyolojik arka planını da açıklayarak anlatmaya çalışalım.
***
1. Bölüm
Genetik hastalıklar meydana geliş şekline göre üç ana grupta toplanır
- Kromozomal rahatsızlıklar : Kromozom sayısı veya yapısında meydana gelen değişikliklerden
 kaynaklananlardır. (Bu makalenin ana konusudur.)
kaynaklananlardır. (Bu makalenin ana konusudur.)
- Monogenetik rahatsızlıklar :Tek bir gende meydana gelen değişikliklerden kaynaklananlardır. Bu değişiklikler, belirli bir enzim veya proteinin kaybına ya da hatalı sentezlenmesine neden olabilir.
- Poligenetik rahatsızlıklar :Birden fazla genden veya çevresel faktörlerin birçok genin faaliyetini etkilemesi sonucu ortaya çıkan hastalıklardır.
Kromozomal Rahatsızlıklar Nedir
Her insan hücresinin içinde bir çekirdek ve bu çekirdeğin içinde genetik materyal DNA bulunur. DNA, hücre çekirdeği içinde spiral merdiven şeklini andıran bir yapıya sahiptir; bu yapıya DNA çift sarmalı denir.
DNA çift sarmalı, 23’ü anneden, 23’ü babadan gelen toplam 46 adet kromozomun etrafında çok sıkı bir şekilde paketlenmiştir. Yani her hücrede 23 çift ya da 46 tek kromozom bulunur. Konuyu daha iyi anlamak için olayı makro düzeyde düşünerek şöyle örnekleyelim:
Vücudumuzdaki milyarlarca hücreden herhangi birini alıp içini açtığımızda, ortasındaki çekirdeği çıkarıp içine baktığımızda 2 adet 1. kromozom, 2 adet 2. kromozom, 2 adet 3. kromozom… ve bu şekilde 22 çift otozomal kromozom olduğunu görürüz.
Burada küçük bir parantez açıp önemli bir noktayı belirtmek gerekir: Bu 22 çift otozomal kromozoma ek olarak, bireyin erkek ya da kadın olmasını belirleyen iki adet de cinsiyet kromozomu bulunur. Bunlar X ve Y kromozomlarıdır. Kadınlardaki cinsiyet kromozom çifti XX, erkeklerdeki kromozom çifti ise XY‘dir.
- Her kız çocuk anneden bir X, babadan bir X kromozomu alır.
- Her erkek çocuk anneden bir X, babadan bir Y kromozomu alır.
Döllenmeden Önce ve Sonra Kromozom Sayısı
Her hücrede 46 adet kromozom bulunur dedik, ancak bu, yumurta döllendikten sonraki kromozom sayısıdır. Döllenme öncesine dönecek olursak, istisnai bir durumla karşılaşırız. Bu istisnai durum, annedeki yumurta hücresi ile babadaki sperm hücresindeki kromozom sayılarıyla ilgilidir. Bu hücrelerdeki kromozom sayısı 46 değil, 23 adettir.
Yumurta döllendiği andan itibaren o yumurta artık embriyodur ve kromozom sayısı 46 adet olur (23’ü anneden, 23’ü babadan). Embriyo döllendikten sonra belirli aralıklarla bölünerek kendini kopyalamaya başlar. Her kopyalamada hücre sayısı iki katına çıkar, yani bölünme 2, 4, 8, 16, 32, 64, 128, 256, … şeklinde ilerler. Her bölünmede aynı zamanda 46 adet kromozom da kopyalanarak yeni hücrenin içinde yerini alır. Bölünme ilerledikçe dokular ve organlar oluşmaya başlar ve 9. ay sonra milyarlarca hücreden oluşan embriyo gelişimini tamamlayarak doğum gerçekleşir.
Bölünmede Hata Olursa
Yukarıda her bölünmede 46 kromozomun da kopyalandığını belirttik, ancak bu kopyalanma her zaman kusursuz olmayabilir. Bazen bu bölünmeler sırasında kopyalama işleminde hatalar oluşabilir. Yapılan araştırmalar, 35 yaş üzeri hamileliklerde hata riskinin daha fazla olduğunu göstermektedir.
Bu hatalar nelerdir? Kopyalamada irili ufaklı hatalar olabilir. Bu hataları iki farklı kategoride değerlendirmek gerekir: Birincisi gen düzeyinde olan hatalar, ikincisi ise kromozom düzeyinde olan hatalar. Hemen belirtelim, kromozom düzeyindeki hataların tahribatı çok daha ağır olur.
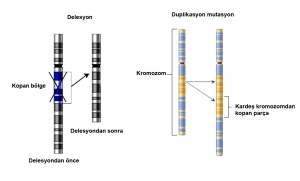
- Gen düzeyindeki hatalar: Bazen tek bir gende, tek bir nükleotidin değişmesiyle oluşan hatalar olabileceği gibi, bazen birden fazla nükleotidin değişmesi şeklinde de olabilir. Bu tür hatalar bazen birden fazla gende de görülebilir. Gen düzeyindeki hatalar sadece nükleotit değişmesi ile sınırlı kalmaz, kimi zaman bir veya birden fazla nükleotitin tamamen ortadan kalkması şeklinde de ortaya çıkabilir (delesyonlar).
- Kromozom düzeyindeki hatalar (kromozom sapmaları): Bu hatalar kimi zaman kromozom sayısıyla, kimi zaman ise kromozomun yapısıyla ilgili hatalar olabilir.
- Sayısal hatalar: Bölünme sırasında kopyalanan kromozomun 1 adet eksik ya da 1 adet fazla olması şeklinde olabilir. Bu durumda kromozom sayısı 46 yerine 45 ya da 47 olur.
- Yapısal hatalar: Bölünme sırasında kopyalanan kromozomun bir parçasının kopması (delesyon), bir parçasının fazla olması (duplikasyon), bir parçasının yönünün ters yönde olması (inversiyon) veya bir parçasının başka bir kromozoma yapışması (translokasyon) şeklinde olabilir.
Her ne durumda olursa olsun, hata meydana geldiği andan itibaren artık yeni hücreler hep hatalı kromozomlar taşıyacaktır. Bu yüzden hata ne kadar geç bölünmede gerçekleşirse, hatalı kromozomu taşıyan hücre sayısı o kadar az olacaktır. Dolayısıyla hastalığın semptomları da o kadar hafif olacaktır.
Kromozom sayısı veya yapısından kaynaklanan bütün bu rahatsızlıklara genel olarak kromozomal hastalıklar adı verilir.
2. Bölüm: Sık Görülen Üç Kromozomal Hastalık
Bu bölümde sık rastlanan ve tedavisi bugün için mümkün olmayan üç hastalıktan bahsedilmektedir. Her üç hastalığın ortaya çıkmasında da annenin hamilelik yaşının önemli rol oynadığını belirtmeden geçmeyelim.
- Down Sendromu (Trizomi 21)
- Edwards Sendromu (Trizomi 18)
- Patau Sendromu (Trizomi 13)
1. Down Sendromu (Trizomi 21)
Down Sendromu (Trizomi 21), en sık görülen kromozomal anomali formlarından biridir ve her ırk ve toplumda aşağı yukarı eşit oranda görülür. Görülme sıklığı 1:500 ile 1:800 arasındadır.
Sebepleri: Hücre bölünmesi sırasında meydana gelen bir hata, 21. kromozomun iki kopya yerine üç kopyasının yapılmasına sebep olur. Sağlıklı insanlarda 46 tek kromozom bulunurken, Down Sendromlu (Trizomi 21) hastalarda bölünmede meydana gelen bu hata nedeniyle 21. kromozom 3 adet bulunur.
Alt Grupları:
- Serbest Trizomi 21 (Freie Trisomie 21): Hücre bölünmesi sırasında meydana gelen bir hatadan (non-disjunction) dolayı, 21. kromozom vücut hücrelerinde iki yerine 3 adet bulunur. Trizomi 21 hastalarının %95’inde tüm vücut hücreleri 3 adet 21. kromozom bulundurur. Her 100 Trizomi 21 sendromlunun %70’i bu formdadır.
- Karyotip: 47,XX+21 veya 47,XY+21
- Translokasyon Trizomi 21: Bu da hücre bölünmesi sırasında meydana gelen bir hatadan kaynaklanır. Trizomi 21 hastalarının %3 ila %4’ü bu forma sahiptir. Bu formda da 21. kromozom vücut hücrelerinde üç adet bulunur, ancak bu, başka bir kromozoma yapışık durumdadır. Yapışık olduğu kromozomlar genellikle 13, 14, 15 ya da 22. kromozomlardır. Nadir olarak 23. (cinsiyet) kromozoma yapışık durumda olanlar da vardır.
- Karyotip: Hangi kromozoma yapışık olduğuna göre değişir. Örneğin: 46,XX,t(21;14) ve 46,XY,t(21;14).
- Mozaik Trizomi 21: Bu tipte, 21. kromozom bazı vücut hücrelerinde üç adet bulunurken, bazılarında 2 adet bulunur. Bilim insanları Down Sendromluların yaklaşık %30’unun bu formda olduğunu tahmin etmektedirler.
- Karyotip: 46,XX / 47,XX,+21 veya 46,XY / 47,XY,+21
- Kısmi Trizomi 21: Bu tip çok nadir görülen bir form olup, tüm dünyada sadece birkaç yüz kişide bulunmaktadır. Bu formda 21. kromozom tüm vücut hücrelerinde iki adet bulunur. Yani 21. kromozom hücrelerde sayı olarak normaldir, ancak 21. kromozomun küçük bir kısmının yine 21. kromozom üzerinde çift olarak bulunması söz konusudur. Bu formun şiddeti de bu kısmın ne derece etkili olduğuna bağlı olarak değişir.
- Karyotip: 46,XXder(21)(q23.2;q22.11) veya 46,XYder(21)(q23.2;q22.11)
Semptomlar: Down Sendromunun (Trizomi 21) semptomları kişiden kişiye çok farklılık göstermekle birlikte, vücut gelişimi ve zihinsel yetenek hemen hepsinde dikkat çeken özellikler arasındadır. Bazı özellikler hemen doğumla birlikte fark edilirken, bazı özellikler ileriki dönemlerde ortaya çıkabilmektedir.
Belirgin bazı özellikler şöyledir:
- Gerek çocukluk, gerekse gençlik dönemi boyunca küçük bir vücut yapısı
- Onikiparmak bağırsağında darlık (duodenal atrezi)
- Bebeklerde kas zayıflığı (hipotoni)
- Doğumsal kalp hastalığı (%40 ile %60 arasında kalp kusurları)
- Gastrointestinal sistemde değişiklikler (pankreasta oluşum bozukluğu, çok genişlemiş kalın bağırsak ve rektum deformasyonu)
- Gözlerde miyopluk ve astigmatizma (%75)
- Şaşılık (%50)
- Gözyaşı kanallarında tıkanıklık (%20)
- Doğumsal katarakt (%3)

Down Sendromu Teşhisi
Günümüzde tıp, Down Sendromu (Trizomi 21) teşhisini bebeğiniz doğmadan önce koyabiliyor. Bu teşhis için çeşitli yöntemler kullanılıyor. Bunlardan biri, ultrasonla bebeğin ense kalınlığını ölçmek. Kalın bir ense, Trizomi 21’in yanı sıra, Trizomi 13 (Patau Sendromu) veya Trizomi 18 (Edwards Sendromu) gibi farklı trizomilerin de belirtisi olabilir.
2012’den beri uygulanan fetal DNA testi (NIPT) de Down Sendromu hakkında ön bilgi veriyor. Bu test, kesin bir teşhis koymasa da, şüpheli durumlarda ek testlerle teyit edilmesi gerektiğini belirtiyor.
Kesin Teşhis Yöntemleri
Ultrason veya NIPT testi sonucunda şüpheli bir durum varsa, kesin teşhis için kromozom analizi yapılıyor. Kromozom analizi farklı yöntemlerle gerçekleştirilebilir:
- Koryonik Villus Örneklemesi (CVS): Plasentadan küçük bir parça alınarak yapılır.
- Kordosentez: Bebeğin göbek bağından kan alınarak yapılır.
- Amniyosentez: Bebeğin içinde yüzdüğü amniyotik sıvıdan bir miktar alınarak yapılır.
Down Sendromu Terapisi
Down Sendromunu tamamen iyileştirmek, mevcut teknolojiyle mümkün değil. Ancak, Down Sendromlu bireylerin hayatlarını kolaylaştırmak, sosyal hayata katılmalarını sağlamak ve kendi kendilerine yetebilmeleri için eğitimler verilebilir. Bu eğitime ne kadar erken başlanırsa, başarı şansı o kadar yüksek olur.
Önemli terapötik önlemler arasında, konuşma, okuma ve yazma becerilerinin geliştirilmesi yer alıyor. Bu eğitimin özel eğitimli profesyonellerce verilmesi çok daha verimli sonuçlar sağlar.
Fiziksel ve Zihinsel Gelişim Desteği
Fiziksel ve zihinsel yeteneklerin geliştirilmesi ve sürdürülmesi için fizyoterapi ve ergoterapi önemli. Ayrıca, kendilerine uygun sporlar yaparak kaslarını güçlendirmeleri de gerekiyor.
Ailelerin sosyal yardımlaşma grupları ve kendi kendine yardım gruplarıyla bir araya gelerek tecrübe paylaşmaları da hem Down Sendromlu çocuğa hem de ailesine yalnız olmadıkları hissini vererek olumlu sonuçlar sağlıyor.
Ek Sağlık Sorunları ve Tedavi
Down Sendromlu bireylerde hipotiroidi veya tekrarlayan solunum yolu enfeksiyonları gibi ek rahatsızlıklar görülebilir. Doktor uygun görürse, bu durumlara yönelik ilaçlı tedavi uygulanabilir.
2. Edwards Sendromu (Trizomi 18)
Edwards Sendromu (Trizomi 18), ağır kromozom bozukluklarından biridir. Toplumda görülme sıklığı çeşitli kaynaklara göre 1:3000 ile 1:8000 arasındadır.
Sebepleri: Tıpkı Down Sendromunda (Trizomi 21) olduğu gibi, annenin hamilelik yaşı önem arz etmektedir. Yapılan araştırmalar, 18 yaşında hamile kalmış bir kadının hamileliğinin 12. haftasından itibaren yaklaşık 1:2500 risk taşırken, 40 yaşında hamile kalmış bir kadının hamileliğinin 12. haftasından itibaren yaklaşık 1:180 Trizomi 18 riski taşıdığını göstermektedir. Yine yapılan araştırmalar, Trizomi 18 olan bir embriyonun %80’inin hamileliğin 12. haftasında öldüğünü göstermektedir. Ayrıca, Trizomi 18’in kız çocuklarda daha fazla görüldüğü de araştırmalarla ortaya konmuştur (Trizomi 18’li 100 çocuktan 75’i kız, 25’i erkektir). Trizomi 18’de de tıpkı Trizomi 21’de olduğu gibi, vücut hücrelerinde iki yerine üç adet 18. kromozom bulunmaktadır.
Alt Grupları:
- Serbest Trizomi 18 (Freie Trisomie 18): Edwards Sendromluların vücut hücrelerinde 18. kromozom üç adet bulunur. Serbest Trizomi 18 formunda, kromozom vücut hücrelerine ilaveten sperm ve yumurta hücrelerinde (gametlerde) de bulunur. Tüm Edwards Sendromluların %95’i bu formdadır.
- Karyotip: 47,XX,+18 veya 47,XY,+18.
- Mozaik Trizomi 18: 18. kromozom bazı vücut hücrelerinde iki adet, bazılarında üç adet bulunur. Yumurta döllendikten sonraki bölünmelerde hata ne kadar geç başlarsa, hastalığın şiddeti de o kadar az görülür. Bu form, Edwards Sendromluların %3’ünü oluşturur.
- Karyotip: 46,XX/47,XX,+18 veya 46,XY/47,XY,+18.
- Kısmi Trizomi 18: Bu formda 18. kromozom tüm vücut hücrelerinde iki adet bulunur. Yani hücrelerdeki 18. kromozom sayısı normaldir, ancak bazen 18. kromozomun küçük bir parçası yine 18. kromozom üzerinde çift olarak bulunur. Bu formun şiddeti, bu ilave parçanın ne derece etkili olduğuna bağlı olarak değişir.
- Translokasyon Trizomi 18: Kromozomun bir parçasının başka bir kromozomda yer almasıyla ortaya çıkan çok nadir bir formdur. Bu form Edwards Sendromluların %1’ini oluşturur. Kromozom seti, parçalı kromozomun hangi kromozoma bağlandığına göre değişir. Örneğin, 22. kromozoma bağlı olması halinde 46,XX,t(18;22) veya 46,XY,t(18;22) şeklinde isimlendirilir.
Semptomlar: Gelişim bozukluğu ana rahminde başlar. Eğer çocuklar ana rahminde ölmeyip de doğarlarsa, çok düşük kiloda doğarlar. Trizomi 18 ile doğan çocuklarda gelişim bozuklukları ve iç organlarda karakteristik deformasyonlar bulunur. Yapılan araştırmalar, çocukların %80’inin kalp kusurları ile doğduğunu göstermektedir.
Belirgin bazı özellikler şöyledir:
- Genel olarak baş çok küçük (mikrosefali)
- Nispeten küçük ağız-çene açıklığı (mikrostomi)
- Gözlerde anomaliler
- Göz kapağı sütunları kısadır
- Alın ve yüzde ağır deformasyonlar (holoprozensefali)
- Ayak başparmağının diğerlerinden ayrık durması (“sandalen furche”)
- El parmaklarının birbiri üzerine gelmesi
- Kulaklarda deformasyon (displastik kulaklar)
- Çocukların %15’inde yarık dudak ve damak
- Deforme olmuş iskelet yapısı
- Kas zayıflığı (hipotoni)
- Eksik kaburga veya omurlar
- Özellikle kalp, böbrek ve üreter, gastrointestinal sistem ve beyinde görülen organ malformasyonları
Teşhis: Hamilelik süresince yapılan ultrason tetkikleri ile yaklaşık olarak Edwards Sendromu (Trizomi 18) için bir ön tanı konulabilir. Ultrason tetkiklerinde bebeğin az hareket etmesi ve gelişmenin normal tempoda seyretmemesi Trizomi 18 için bir işaret olabilir. Fakat bu konuda en kesin teşhis kromozom testi ile ortaya çıkar. Yapılan kromozom testi, bebeğin Edwards Sendromu (Trizomi 18) olup olmadığını %100 doğrulukta ortaya çıkarır. Hatta kandaki lenfosit hücreleri ile yapılan genetik testler, Trizomi 18’in hangi alt formda olduğunu da gösterir. 35 yaş üzeri hamilelikler bu konuda risk oluşturduğu için mutlaka genetik testler yaptırılmalıdır.
Terapi: Edwards Sendromunun (Trizomi 18) hiçbir tedavisi yoktur. Birçok bebek daha doğmadan anne karnında ölür. Doğan çocuklar ise organ hasarlarının durumuna göre 12 aya kadar yaşayabilir. Nadir de olsa yetişkinlik yaşına kadar ulaşan çocuklar da vardır, ancak bunlar sadece istisnai durumlardır. Yaşayanlar arasında kız çocukları erkeklere göre daha uzun hayatta kalırlar. Hayatta kalanların ilerleyen sürede ölüm sebepleri arasında kalp yetmezliği ve solunum yetmezliği birinci sırada yer alır.
3. Patau Sendromu (Trizomi 13)
Patau Sendromu (Trizomi 13), Trizomi 21 ve Trizomi 18 gibi tedavi edilemeyen ağır kromozomal bozukluklardan biridir. Bozukluk, 13. kromozomun vücut hücrelerinde iki adet yerine üç adet bulunmasından kaynaklanır. Yukarıda anlatılan diğer iki hastalık gibi, bunda da annenin hamilelik yaşı önemlidir. Yani anne olma yaşı ilerledikçe risk de artar.
Bebekler anne karnında genellikle yeterli beslenemediği için yüksek derecede organ anomalileri ile doğarlar. Özellikle beyin, böbrek, kalp ve bağırsaklarda ciddi anomaliler görülür. İleri formlarında tek göz, yarık dudak ve damak ve altı parmaklılık (polidaktili) da görülebilir.
Patau Sendromu ile doğan çocuklar, tıpkı diğerleri gibi ne iyileştirilebilir ne de tedavi edilebilirler. Anne karnında ölmeyip doğan çocukların çoğu yaşamın ilk 6 gününde ölürken, bazıları bir yıl kadar yaşayabilir. Bunda da kız çocuklar erkek çocuklara göre biraz daha uzun yaşarlar. Patau Sendromu toplumda görülme sıklığı yaklaşık 1:10.000’dir.
Alt Grupları:
- Serbest Trizomi 13 (Freie Trizomi 13): Patau Sendromluların %80’ini bu form oluşturur. Cinsiyet kromozomlarından birinde (yumurta veya sperm hücresi) fazladan bir 13. kromozom bulunması, döllenme sonrası vücut hücrelerinde üç adet 13. kromozom bulunmasına sebep olur.
- Karyotip: 47,XX,+13 veya 47,XY,+13.
- Mozaik Trizomi 13: 13. kromozom bazı vücut hücrelerinde iki adet, bazılarında üç adet bulunur. Yumurta döllendikten sonraki bölünmelerde hata ne kadar geç başlarsa, hastalığın şiddeti o kadar az görülür. Mozaik Trizomi 13 olan çocukların vücut hücrelerinde hem 47 kromozom, hem de 46 kromozom bulunur.
- Karyotip: 46,XX/47,XX,+13 veya 46,XY/47,XY,+13.
- Kısmi Trizomi 13: Bu formda 13. kromozom tüm vücut hücrelerinde iki adet bulunur. Hücrelerdeki 13. kromozom sayısı normaldir, ancak bazen 13. kromozomun küçük bir parçası yine 13. kromozom üzerinde çift olarak bulunur. Bu formun şiddeti de bu parçanın ne derece etkili olduğuna bağlı olarak değişir.
- Translokasyon Trizomi 13: 13. kromozomun bir parçasının başka bir kromozoma yapışması ile ortaya çıkan ve çok nadir görülen bir formdur. Parça genellikle 14, 15, 21 veya 22. kromozoma yapışık olarak bulunur. Bu form Patau Sendromluların %1’ini oluşturur. Kromozom seti, parçanın hangi kromozoma bağlandığına göre değişir. Örneğin, 14. kromozoma bağlı olması halinde 46,XX,t(14;13) veya 46,XY,t(14;13) şeklinde isimlendirilir.
Semptomlar: Dış görünüş ve iç organlardaki gelişim bozukluğu döllenmeden hemen sonra anne karnında başlar. Semptomlar her çocukta farklı şiddette ve farklı şekillerde görünür. Doğum öncesi yapılan ultrason tetkiklerinde Trizomi 13 varlığına işaret eden bazı bulgular görülür, kesin teşhis kromozom testi ile ortaya çıkarılır.
Belirgin bazı özellikler şöyledir:
- Kalp yetmezliği (çocukların yaklaşık %80’inde)
- Nispeten küçük bir vücut yapısı
- Çocukların yaklaşık %12’sinde nispeten küçük baş
- Çocukların yaklaşık %45’inde yarık dudak ve damak
- Nispeten küçük ve birbirine nispeten yakın gözler (hipotelorizm)
- Çocukların yaklaşık %30’unda ürogenital sistem ve böbrek bozuklukları
- Beyinde malformasyonlar (örneğin, holoprozensefali)
- Burun deliklerinde malformasyon
- Kulaklarda anomaliler
- Yüz iskeletinde anomaliler
- Parmaklarda deformasyonlar (örneğin, polidaktili)
Trizomi 13 ile doğan çocuklar genellikle kör veya sağır olurlar ve genellikle kalp yetmezliği veya solunum yetmezliğinden çok erken ölürler.
Teşhis: Doğum öncesi yapılan ultrasonografi (sonografi) tetkiklerinde fetusta malformasyonların (örneğin; beyin malformasyonu, yarık dudak ve damak ve altı parmak gibi anomaliler) bulunması durumunda mutlaka kromozom analizi yapılarak bebeğin Trizomi 13 olup olmadığı kontrol edilir. Hatta bu testlerde varsa hangi formda olduğu da tespit edilebilir. Genel olarak söylemek gerekirse, 35 yaş üzeri hamileliklerin hepsinde mutlaka kromozom analizi yaptırılması gerekir.
Terapi: Trizomi 13 de Trizomi 18 gibi henüz tedavi edilebilir bir hastalık değildir. Hayatta kalan bebekler için birtakım operasyonlar ve sınırlı fizyolojik tedaviler yapılabilir, ancak bunlar sadece var olan durumu biraz daha iyileştirmeye yönelik tedavilerdir.
Sonuç
Her üç vakada da (Trizomi 21, Trizomi 18 ve Trizomi 13), hücre bölünmesi sırasında meydana gelen bir hata, kromozomların iki adet yerine üç adet kopyalanmasına sebep olmaktadır. Hata sonucunda ortaya çıkan hasarın boyutu, hatanın büyüklüğüne göre değişir. Hasarın neden bu kadar büyük olduğu konusuna gelince, ayrıntılar elbette tam olarak bilinmiyor. Kanaatimce bu konuda bilinenler, bilinmeyenlerin on binde biri bile değildir. Üç kromozomun (21, 18, 13) her birinde yaklaşık 350 ile 600 arasında gen vardır. Muhtemelen fazladan bu kadar genin çalışması, organ ve dokularda geri dönüşü mümkün olmayan bozukluklara sebep olmaktadır.
Kromozom bozuklukları ile ilgili hazırlanmış diğer makaleler
Mehmet Saltuerk
++++++++++++++++++++++++
Dipl. Biologe Mehmet Saltürk
The Institute for Genetics
of the University of Cologne
++++++++++++++++++++++++
Kaynaklar
- Chromosome 21 and down syndrome: from genomics to pathophysiology. Link
- Neurobehavioral disorders in children, adolescents, and young adults with Down syndrome Link
- Behavioral phenotype of individuals with Down syndrome. Link
- Current dilemmas in Down syndrome clinical care: celiac disease, thyroid disorders, and atlanto-axial instability.Link
- Speech intelligibility and childhood verbal apraxia in children with Down syndrome Link
- Families of children with Down syndrome:What we know and what we need to know Link
- The brain in Down syndrome (TRISOMY 21). Link
- Down’s syndrome. Link
- Down syndrome and associated congenital malformations. Link
- Developmental disabilities grown up: Down syndrome. Link
- Trisomy 13 mosaicism: study of serial cytogenetic changes in a case from early pregnancy to infancy. Link
- Trisomies 13 and 18: population prevalences, characteristics, and prenatal diagnosis, metropolitan Atlanta, 1994-2003Link
- Trisomy 13 mosaicism in a phenotypically normal child: description of cytogenetic and clinical findings from early pregnancy beyond 2 years of age.Link
- Transcriptome analysis of human autosomal trisomy.Link
- Pediatric Cardiac Care Consortium. Effectiveness of cardiac surgery in trisomies 13 and 18 (from the Pediatric Cardiac Care Consortium-3.Link
- The origin of trisomy 13. Link
- Patau syndrome with a long survival (146 months): a clinical report and review of literature.Link
- Trisomy 13 and trisomy 18 in a defined population: epidemiological, genetic and prenatal observations..Link
- Congenital malformations among liveborn infants with trisomies 18 and 13.Link
- Population-based analyses of mortality in trisomy 13 and trisomy 18. Link
- Heart Malformations in Children With Down Syndrome Link
- Rates and survival of individuals with trisomy 13 and 18 Data from a 10-year period in Denmark link
- Patau syndrome with a long survival. A case report link
- http://www.zeit.de/2015/04/praenataldiagnostik-down-syndrom-krankenkasse,
- Klaus Sarimski: Entwicklungspsychologie genetischer Syndrome (3. Auflage, 2003)
- Der Test link
Bu blogdaki makaleler bir başka yayın organında kaynak gösterilmeden yayınlanamaz, çoğaltılamaz ve kullanılamaz.
Bunu beğen:
Beğen Yükleniyor...


 .(7)
.(7) 13)
13)










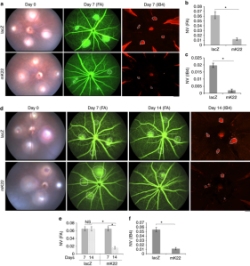

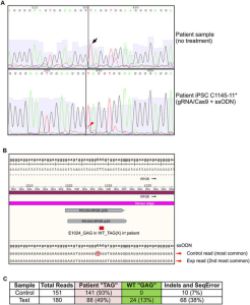


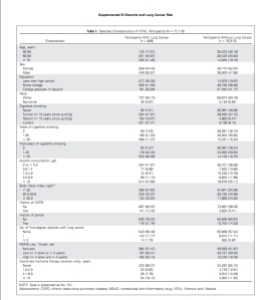







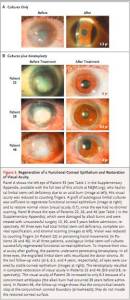


 balığının ürettiği Skualamin ise Alfa-Synuclein’in yanlış katlanmasından kaynaklanan bütün bu olumsuzlukların önüne geçiyor
balığının ürettiği Skualamin ise Alfa-Synuclein’in yanlış katlanmasından kaynaklanan bütün bu olumsuzlukların önüne geçiyor