Körlük, her iki gözün görme yetisini tamamen ya da büyük oranda kaybettiği durumlarda konulan teşhistir. Körlük doğumla gelen bir engel olduğu gibi diyabet, glokom, enfeksiyonlar, retina hasarları, genetik yatkınlık, yaşa bağlı makula dejenerasyonu gibi birçok sebepten de kaynaklanabilir. Bazı körlük veya görme kayıpları ilaçla veya cerrahi müdahale ile tedavi edilebilir veya ilerlemesi kontrol altında tutulabilir iken, bazılarının maalesef şimdilik tedavisi mümkün değil ama bilim ve teknolojide baş döndürücü gelişmeler bu konuda çare bekleyen hastaların umutlarını güçlendiriyor.
gelen bir engel olduğu gibi diyabet, glokom, enfeksiyonlar, retina hasarları, genetik yatkınlık, yaşa bağlı makula dejenerasyonu gibi birçok sebepten de kaynaklanabilir. Bazı körlük veya görme kayıpları ilaçla veya cerrahi müdahale ile tedavi edilebilir veya ilerlemesi kontrol altında tutulabilir iken, bazılarının maalesef şimdilik tedavisi mümkün değil ama bilim ve teknolojide baş döndürücü gelişmeler bu konuda çare bekleyen hastaların umutlarını güçlendiriyor.
Son yıllarda kök hücre ve CRISPR-Cas9 gibi bilimde adından sıkça bahsettiren teknikler ile tedavisi mümkün olmayan birçok hastalığa çare aranıyor. Aşağıda son yıllarda bu tekniklerle sürdürülen araştırmalardan bazı örnekler yer almaktadır.
Araştırmalara geçmeden önce konunun dışında olan okuyucuların konuyu daha iyi anlayabilmeleri için Kök hücre ve CRISPR-Cas9 teknolojisi konusunda biraz ön bilgi vermek gerekiyor.
Kök hücre nedir : Henüz bölünerek farklılaşmaya başlamamış yani özelleşmemiş ama özelleşmiş her hücreye dönüştürülme potansiyeline sahip hücrelerdir. Yani ciltten alınan bir kök hücreyi laboratuvar ortamından gözdeki retina hücresine veya pankreasda insülin hücrelerine ya da midede sindirim hücresine dönüştürmek mümkündür.
CRISPR-Cas9 nedir : CRISPR-Cas9, herhangi genin herhangi bir kısmının kesilip çıkarılması veya çıkarılan kısma başka bir parçanın konmasını sağlayan teknolojidir. Bu teknoloji ile genetik bir hastalığa sebep olan bir mutasyonun değiştirilip genin sağlıklı bir şekilde çalıştırılması mümkün olabilir.
Açıklama: Gerek kök hücre, gerekse CRISPR-Cas9 teknolojisi genetikte oldukça yeni sayılabilecek teknikler olmasına rağmen birçok genetik laboratuvarında, birçok hastalığın tedaviye dönük araştırmasında kullanılıyor hatta bazen direkt tedavide de rutin olarak uygulanabiliyor. Hemen belirtmekte fayda var; bu iki teknik oldukça yeni ve uygulamalarda ara sıra aksamalar olabiliyor. İlerleyen zamanda bu tekniklerin kusursuz çalışması yönünde inançlar büyük.
Bu kısa açıklamadan sonra artık yapılan araştırmalara geçebiliriz.
1. Araştırma: Yaş tip makula dejenerasyonu tedavisi için göz damlası geliştirildi
Hemen belirtelim geliştirilen bu damla geriye dönük bir iyileştirme sağlamıyor aksine mevcut cerrahi tedaviye iyi bir alternatif ve büyük bir kolaylık sağlıyor.
Yaşa bağlı makula dejenerasyonu yani sarı nokta hastalığı en sık rastlanan körlük nedenlerinden biridir. Yaş ve kuru olmak üzere iki tipe ayrılır.
Yaş tip makula dejenerasyonu : Gözün arka tarafında ışığa duyarlı retina tabakasının altındaki kan damarlarının anormal 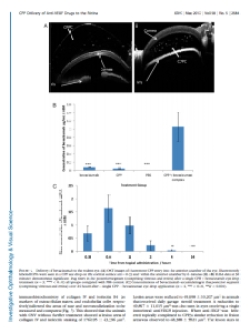 çoğalması ve gelişmesiyle meydana gelir. VEGF proteinin aşırı salgılanması ile oluşan bu istenmeyen damarlar retina tabakasının altında ödem ve kanamalara neden olur. Yeni damarların oluşumunu durdurmak için ya VEGF proteinini bloke etmek ya da aktivitesini durduracak Anti-VEGF ilaçlara gerek var. Bu konuda piyasada çeşitli Anti-VEGF ilaçlar bulunmaktadır ve bu ilaçlar göze iğne batırılarak yani enjeksiyon yoluyla hastaya veriliyor. Bu operasyonel yöntem her ne kadar ağrısız-sızısız olsa da hastanın enjeksiyon sonrası enfeksiyon kapması, retina dekolmanı ve katarakt oluşumu gibi yan etkileri olabilmektedir. Anti-VEGF ilaçların en büyük dezavantajı ise göz içine belirli aralıklara düzenli olarak enjeksiyon yapılmak zorunda kalınması. Bu durum hem hasta hem de doktor için sıkıntılı ve stresli bir durum.
çoğalması ve gelişmesiyle meydana gelir. VEGF proteinin aşırı salgılanması ile oluşan bu istenmeyen damarlar retina tabakasının altında ödem ve kanamalara neden olur. Yeni damarların oluşumunu durdurmak için ya VEGF proteinini bloke etmek ya da aktivitesini durduracak Anti-VEGF ilaçlara gerek var. Bu konuda piyasada çeşitli Anti-VEGF ilaçlar bulunmaktadır ve bu ilaçlar göze iğne batırılarak yani enjeksiyon yoluyla hastaya veriliyor. Bu operasyonel yöntem her ne kadar ağrısız-sızısız olsa da hastanın enjeksiyon sonrası enfeksiyon kapması, retina dekolmanı ve katarakt oluşumu gibi yan etkileri olabilmektedir. Anti-VEGF ilaçların en büyük dezavantajı ise göz içine belirli aralıklara düzenli olarak enjeksiyon yapılmak zorunda kalınması. Bu durum hem hasta hem de doktor için sıkıntılı ve stresli bir durum.
Anti-VEGF damla: Birmingham Üniversitesi tarafından enjeksiyonun yerini alacak bir damla geliştirildi. Geliştirilen bu damla birkaç dakika içerisinde hücre zarından geçerek hücreye nüfuz etme özelliğine sahip bir peptitten (CPP:cell-penetrating peptide) oluşuyor. İlaç göze damlatıldıktan hemen sonra dakikalar içerisinde retina üzerindeki sarı noktaya yani keskin görüşten sorumlu bölgeye ulaşıyor.
Geliştirilen bu göz damlasının hastanın bizzat kendisi tarafından uygulanabilecek olması yaş tip makula dejenerasyonu tedavisinde büyük kolaylık sağlayacak. (1)
Başka bir damla daha var: Trinity College/Dublin tarafından geliştirilen ve 2 Nisan 2014 tarihinde Science Translational Medicine dergisinde yayınlanan bir başka makalede Anti-VEGF ilaçlara alternatif ve yan etkisi hiç olmayan bir damlanın geliştirildiği belirtiliyor. (2)
2. Araştırma: Körlükle mücadele önemli bir protein keşfedildi
Retina distrofileri, görme işlevinin kronik ve ilerleyici bozukluklarından biridir. (Not: Distrofi: tıpta doku anomalileri olarak nitelendirilir). Çeşitli sebeplerden kaynaklanabileceği gibi genetik sebeplerden de kaynaklanabilir. Genetik kaynaklı retina distrofilerinin toplumda görülme sıklığı 4000 de 1 gibi oldukça seyrek sayılabilecek bir oranda bulunmaktadır. Sebebin yaklaşık 180 gende meydana gelen mutasyondan kaynaklandığı düşünülüyor. Genetik kaynaklı retina distrofilerinin mekanizmasının nasıl işlediği, hastalığın ortaya çıkmasında hangi proteinlerin rol oynadığı, bu proteinler ile görme sinirleri arasında nasıl bir olumsuz etkileşim olduğu uzun yıllar bilinmiyordu artık bu bilinmezlik ortadan kalktı.
Florida campus of The Scripps Research Institute (TSRI) tarafından yapılan ve 22 mart 2017 tarihinde Neuron dergisinde yayınlanan bir araştırmada retina distrofisine sebep olan α2δ4 adında bir proteinin kilit rol oynadığı ve bu protein eksikliğinin retina distrofisine sebep olduğu bulundu.
α2δ4 önemi nedir : α2δ4 proteininin neden önemli olduğu konusunu geçmeden önce konunun daha iyi anlaşılması için retinanın yapısı ve üzerinde bulunan sinir hücreleri / fotoreseptörler hakkında çok kısa bilgi vermek uygun olacak.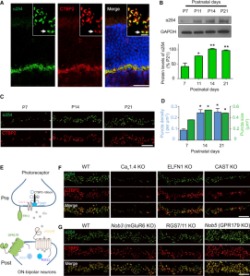
Retina ya da ağ tabaka, gözün iç kısmını çevreleyen ince, yarı saydam bir tabakadır. Retinanın arka kısmında ise keskin görmeyi sağlayan ışığa ve renklere duyarlı çeşitli fotoreseptörlerin yoğun olarak bulunduğu sarı nokta yer alır. Sarı noktaya gelen ışık, renk veya herhangi bir görüntü bir takım biyokimyasal reaksiyonlardan geçtikten sonra elektrik sinyallerine dönüştürülerek beyne ulaşır. Bu bilgi iletimini gözün içinden beyne doğru fotoreseptör hücreleri sağlar ve hücreler sırasıyla ganglion, bipolar, koni ve çubuk hücreleridir.
α2δ4 proteininin fonksiyonu : Ganglion hücreleri ile bipolar hücrelerinin bağlantı noktalarında yani sinapslarda ELFN1 adında bir protein görev yapar ve protein bipolar hücrelerindeki kalsiyum kanallarını açarak glutamat denen bir amino asit esterinin salınımına sebep olur. Glutamat ise ganglion ve bipolar hücrelerini birbirine yapıştırarak gelen sinyallerin koni ve çubuk hücreler aracılığıyla beyne ulaşmasını sağlar ve görme işlemi tamamlanır. Retina distrofi körlüğü denen şey işte bu yapışmanın gerçekleşmemesi durumunda ortaya çıkan bir hastalıktır.
Uzun yıllar ELFN1 proteinin ganglion hücreleri ve bipolar hücrelerinin birbirine yapışmasında rol oynadığı bilinmesine rağmen retina distrofi körlüğünde bu proteinin niye bu görevi yerine getiremediği, niye yapışmanın sağlanamadığı bilinmiyordu.
α2δ4 yapışmayı sağlıyor : Florida Campus of The Scripps Research Institute (TSRI) tarafından yapılan araştırmada, α2δ4 adındaki proteinin ELFN1 proteinini aktive ederek kalsiyum kanallarınının açılmasına olanak sağladığı ve buna bağlı olarak glutamat geçişine izin verdiği bulundu.
Deneyin nasıl yapıldığı hakkında kısa bilgi : Sıkıcı ayrıntılara girmeden deneyin nasıl yapıldığına da çok yüzeysel olarak değinelim: Farelerde α2δ4 proteinini sentezleyen genin devre dışı bırakılmasıyla birlikte ve farelerde retina distrofi körlüğünün başladığı, genin tekrar aktif hale getirilmesi ile kalsiyum kanallarının tekrar açılarak farelerin tekrar gördüğü tespit edildi.
Yeni çalışmalar yolda : Gerek yaşa bağlı gerekse genetik olarak ortaya çıkan retina distrofi körlüğünde fotoreseptörler ölüyor. Normalde ölen fotoreseptörlerin yerine yenisi gelmiyor ve şu an uygulanan tedavi yöntemleri ise var olan ölmemiş reseptörlerin korunmasına yönelikti. Her ne kadar kök hücre teknolojisi yeni olsada bu konuda yapılan araştırmalar umutları güçlendiriyor. Ölen fotoreseptörlerin yerine kök hücre transferi ile yenisini koymak ve yeni fotoreseptörlerin α2δ4 proteini ile koruyarak kalıcı ve sağlıklı bir göze sahip olmak yakın bir gelecekte mümkün görünüyor. (3)
3. Araştırma: CRISPR-Cas9 tekniği ile yaşa bağlı makula dejenerasyonu tedavisi
Yaşa bağlı makula dejenerasyonu sebeplerinden biri de genetik kaynaklıdır ve rahatsızlığa VEGFR2 geninde meydana gelen bir mutasyon sebep olmaktadır. Yukarıda da bahsedildiği gibi bu mutasyon gereğinden fazla VEGF proteini 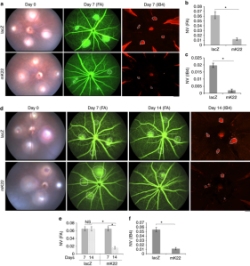 üretilmesine aracılık ederek retina tabakasının altındaki damarların anormal çoğalmasına sebep oluyor.
üretilmesine aracılık ederek retina tabakasının altındaki damarların anormal çoğalmasına sebep oluyor.
Başarılı bir çalışma : CRISPR-Cas9 teknoloji ile VEGFR2 genindeki mutasyonlu kısmı alınarak yerine başarılı bir şekilde genin mutasyonsuz yani sağlıklı formu injekte edildi. Transfer sonrası retina tabakasının altında kan damarlarının anormal çoğalması durdurularak makula dejenerasyonun önüne geçildi. (4)
İlave bilgi : CRISPR-Cas9 teknoloji de kök hücre teknoloji gibi yeni bir tedavi yöntemi olup kalıtsal hastalıkların tedavisinde büyük umut vaad ediyor. CRISPR-Cas9 tekniğinin prensibi, genomun istenilen bir kısmına ekleme-çıkarma ya da değişiklik yapmaya dayanıyor. Buna göre hastalığa sebep olan genin mutasyonlu kısmı CRISPR-Cas9 teknoloji ile kesilerek yerine sağlıklı parçanın eklenmesi ve hastalığa sebep olan mutasyonun ortadan kaldırılması mümkün.
4. Araştırma : Makula dejenerasyonuna yol açan iki mutasyon
Oldukça erken sayılabilecek bir yaşta başlayan ve x-linked retinoschisis (XLRS) olarak da isimlendirilen ve makula dejenerasyonuna sebep olan bu körlük tipi toplumda yaklaşık her 5,000 erkekte bir görülüyor. Hastalığın şimdilik geriye dönük tedavisi yok ama Manchester Üniversitesinin yapmış olduğu araştırmada ortaya çıkarılan iki mutasyon gelecekte x-linked retinoschisis hastalarına yeni tedavi imkanlarının yolunu açacak gibi görünüyor.
Tehlike iki mutasyon : Yapılan bu araştırmada RS1 geninde bulunan iki mutasyonun hatalı XLRS1 proteini kodlayarak retinada yavaş yavaş ilerleyen kademeli tahribata yani X-linked retinoschisis sebep olduğu bulundu.
Süreç nasıl işliyor : Sağlıklı bireylerde XLRS1 proteini retinanın hücresel organizasyonunda çok önemli bir rol oynamaktadır. Bu protein, birbirinin aynı sekiz proteinden oluşan sekizgen bir yapı oluşturarak (Homo-oligomerik-protein) retinada fotoreseptör ve bipolar hücrelerinin oluşmasına öncülük ediyor.
RS1 geninde meydana gelen bu iki mutasyon XLRS1 Proteinin sekizgen yapısını değiştirerek retina hücrelerinde tahribatına sebep oluyor ve bu tahribat oldukça erken sayılabilecek yaşlarda hastanın görme yetisini kaybetmesine sebep oluyor. Başka bir ifade ile sağlıklı gen retinayı korurken, mutasyonlu gen retinayı tahrip ederek körlüğe sebep oluyor.
Bu iki mutasyonun keşfinden sonra kök hücre ve CRISPR-Cas9 teknolojisi kullanılarak tahrip olan retina tabakası ve ölen sinir hücrelerinin tedavisinde yeni ufuklar açılacak. (6)
5. Araştırma : CRISPR-Cas9 tekniği ile Gece körlüğü tedavisi
Halk arasında gece körlüğü veya tavuk karası olarak da bilinen Retinitis pigmentosa, fotoreseptör hücrelerinin tahribatı ile başlayan ve ilerleyen safhada ciddi görme kaybıyla sonuçlanan genetik bir hastalıktır.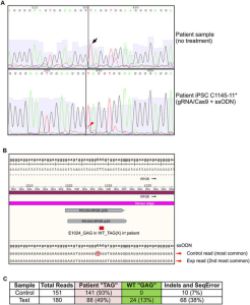
Hastalık, 3459 nükleotit uzunluğundaki RPGR genin 3070. pozisyonunda meydana gelen mutasyonun protein sentezini durdurmasından kaynaklanıyor. Bu pozisyonda Guanin (G) yerine gelen Timin (T), protein sentezine „DUR“ komutu veren kodu oluşturuyor. Yani gen sentezlemesi gereken 1152 amino asit uzunluğundaki protein yerine 1024 amino asit uzunluğunda kısa bir protein sentezliyor. Başka bir ifade ile gendeki mutasyon eksik protein sentezlenmesine, bu eksik protein de gece körlüğüne sebep oluyor.
Gece körlüğünde tedavi : Columbia University Medical Center (CUMC) ile Lowa Üniversitesi‘nin ortaklaşa yaptığı çalışmada RPGR gene’nin hatalı protein sentezleyen kısmı CRISPR-Cas9 teknoloji kullanılarak düzeltildi ve gece körlüğü tedavi edildi.
Gece körlüğü tedavisinde kullanılan CRISPR-Cas9 tekniği kısaca şu aşamalardan geçerek hastaya uygulandı.
- Hastanın cildinden küçük bir doku alındı ve laboratuvarda özel kimyasallar içerisinde çoğaltıldı.
- Alınan dokular daha sonra özelleşmiş fotoreseptör kök hücrelerine dönüştürüldü.
- Elde edilen kök hücrelerin RPGR genindeki mutasyonlu kısım CRISPR-Cas9 tekniği ile düzeltilerek RPGR geni sağlıklı forma getirildi.
- Düzenlenmiş kök hücreler göze transfer edilerek gözün tekrar görmesi sağlandı. (5)
6. Araştırma : Gen terapisi ile renk körlüğü tedavi edildi
Renk körlüğü, gözün retina tabakasında yer alan koni hücrelerinin genellikle genetik sebeplerden dolayı renkleri algılayamaması sonucu ortaya çıkan ve tedavisi şimdilik mümkün olmayan bir hastalıktır.
İyon kanallarındaki arıza : Hastalığa çoğunlukla CNGA3 veya CNGB3 genlerindeki mutasyonlar yol açıyor ve bu mutasyonlar koni hücrelerinde bulunan iyon kanallarında bir takım hasarlara yol açarak hücrlerin renkleri algılayamamasına sebep oluyor.
Tübingen Üniversitesi ve Ludwig-Maximilians-Münih Üniversitesi‘nin ortaklaşa yaptığı araştırmada renk körü farelerin iyon kanalları genetiği değiştirilmiş virüslerin yardımı ile tekrar fonksiyonel hale getirilerek farelerin renkli görmesi sağlandı.
Farelerde başarılı olan bu metodun insanlarda başarılı olup olmayacağını söylemek erken olsa da bu çalışma renk körü hastalar için bir umut olabilir. (7)
Benzer konuda hazırlanmış diğer yazılar
- Körlük ve kök hücre tedavisi
- Biyonik göz
- Retina körlüğüne çare olabilecek yeni bir kimyasal madde bulundu
- Diyabete bağlı görme bozukluğu tedavisinde umut
- Yapay kornea: Korneadan kaynaklanan körlüğe son.
Mehmet Saltuerk
++++++++++++++++++++++++
Dipl. Biologe Mehmet Saltürk
The Institute for Genetics
of the University of Cologne
++++++++++++++++++++++++
Kaynaklar
- Topical Delivery of Anti-VEGF Drugs to the Ocular Posterior Segment Using Cell-Penetrating Peptides
- Interleukin-18 and IL-18 binding protein
- The Auxiliary Calcium Channel Subunit α2δ4 Is Required for Axonal Elaboration, Synaptic Transmission, and Wiring of Rod Photoreceptors
- Genome editing abrogates angiogenesis in vivo
- Precision Medicine: Genetic Repair of Retinitis Pigmentosa in Patient-Derived Stem Cell
- Structural analysis of X-linked retinoschisis mutations reveals distinct classes which differentially effect retinoschisin function
- Restoration of Cone Vision in the CNGA3−/− Mouse Model of Congenital Complete Lack of Cone Photoreceptor Function
Bu blogdaki makaleler bir başka yayın organında kaynak gösterilmeden yayınlanamaz, çoğaltılamaz ve kullanılamaz.

Heyecan verici bir gelişme. Gerçekten sevindim.
kızım 43 yaşında,halk arasındaki deyimi ile tavuk karası,bu hstalık ile yeni gelişmeleri ve tedavinin var olup olmadıgını ögrenmek istiyorum.bildirirmisiniz.